Ce que l’on appelle communément le gluten est en fait un mélange de prolamines et de gluténines, deux familles de protéines. C’est la présence de gluten dans une farine qui la rend panifiable. C’est le gluten qui confère sa résistance et son élasticité à la pâte à pain. C’est lui qui permet à la pâte de lever via la fermentation puis au four. Ceci explique d’ailleurs pourquoi les personnes qui suivent un régime sans gluten ne peuvent plus manger de pain dès lors qu’il est à base de farine de blé, seigle ou orge.
Prolamines et gluténines
Certaines protéines de la famille des prolamines se retrouvent dans de nombreuses céréales comme le blé (la prolamine du blé s’appelle la gliadine), l’épeautre (gliadine), le kamut (gliadine), le seigle (sécaline), l’orge (hordéine). Ces prolamines sont considérées comme toxiques pour les personnes atteintes de maladie coeliaque.
On retrouve des prolamines dans d’autres céréales comme l’avoine (avénine), le maïs (zéine), le sorgho (cafirine), le riz (orzénine) ou le millet (panicine), mais ces dernières ne semblent pas toxiques bien qu’il existe une controverse importante pour ce qui est de l’avoine.
Les gluténines sont également toxiques pour les malades coeliaques, mais à un moindre degré. Au total il y a plus de cinquante résidus protéiques du gluten qui sont identifiés comme toxiques pour les malades coeliaques.
Malabsorption du gluten et maladie coeliaque
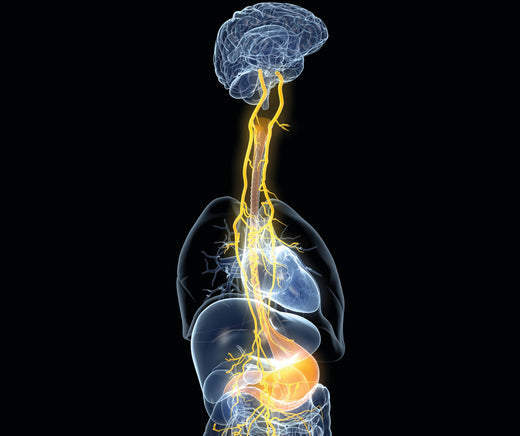
Selon les recherches les plus récentes sur la maladie coeliaque, le mécanisme qui en est à l’origine est le suivant : lors de la digestion, les enzymes découpent les protéines en morceaux de petite taille ; dans le cas du gluten, cette découpe est incomplète et des fragments non digérés se retrouvent au niveau de l’intestin grêle. Pour des raisons inconnues, l’intestin voit sa perméabilité augmenter – il se peut que ce soit le gluten lui-même qui soit à l’origine de cette augmentation de la perméabilité –, si bien que des fragments passent au travers des jonctions serrées. Ces fragments rencontrent alors une enzyme appelée transglutaminase tissulaire 2 qui modifie légèrement leur structure. Ces nouvelles protéines ont un potentiel antigénique, c’est-à-dire que, chez des personnes prédisposées, elles vont provoquer une réaction immunitaire et déclencher la production d’anticorps : les malades coeliaques présentent des anticorps de type IgA dirigés contre la gliadine du gluten et contre la transglutaminase tissulaire 2. Cette réaction va provoquer une réponse inflammatoire qui aura pour conséquence la destruction progressive des villosités intestinales chargées de l’assimilation des aliments. La raison pour laquelle le système immunitaire passe d’une simple attaque envers la gliadine à une attaque envers la transglutaminase et l’intestin lui-même n’est pas encore comprise mais de nombreuses hypothèses sont soulevées.
À l’arrêt de la consommation de gluten, les anticorps disparaissent progressivement. Au terme de plusieurs mois, l’intestin cicatrise et le malade est en rémission. La présence de la moindre molécule de gluten dans l’organisme redéclenche l’attaque dirigée contre la muqueuse intestinale et donc la maladie.
Lire aussi : 3 choses importantes à savoir sur le gluten et le "sans gluten", par Thierry Souccar